그리냐르 시약
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
그리냐르 시약은 유기 할로겐화물과 마그네슘의 반응을 통해 생성되는 유기금속 화합물로, 다양한 유기 화합물 합성에 널리 사용된다. 1900년 빅토르 그리냐르에 의해 처음 합성되었으며, 1912년 노벨 화학상을 수상했다. 그리냐르 시약은 알데히드, 케톤 등의 카르보닐 화합물과의 반응을 통해 알코올을 생성하며, 친핵성 치환, 염기로서의 반응 등 다양한 반응에 참여한다. 유기 합성 분야에서 중요한 역할을 하며, 의약품, 농약, 고분자 등의 생산에 활용된다.
더 읽어볼만한 페이지
- 유기금속화학 - 유기 발광 다이오드
유기 발광 다이오드(OLED)는 유기 화합물의 자체 발광 현상을 이용한 소자로, 1987년 코닥의 2층 구조 소자 개발 이후 효율과 수명이 향상되어 스마트폰, TV 등 다양한 분야에 상용화되었으며, 높은 명암비와 빠른 응답 속도 등의 장점과 함께 수명 및 번인 현상 등의 단점을 극복하기 위한 기술 개발이 진행 중이다. - 유기금속화학 - 다면체 골격 전자쌍 이론
다면체 골격 전자쌍 이론은 클러스터 화합물의 구조를 예측하는 이론으로, 4n, 5n, 6n 규칙을 통해 클러스터 내 전자 수를 기반으로 구조를 예측한다. - 탄소-탄소 결합 형성 반응 - 만니히 반응
만니히 반응은 아민, 포름알데히드, 카르보닐 화합물을 사용하여 β-아미노 카르보닐 화합물을 생성하는 유기 반응이다. - 탄소-탄소 결합 형성 반응 - 네기시 반응
네기시 반응은 팔라듐 또는 니켈 촉매를 사용하여 유기아연 화합물과 유기 할로겐 화합물 간의 탄소-탄소 결합을 형성하는 교차 커플링 반응으로, 천연물 합성 및 의약품 개발에 응용되어 네기시 에이이치에게 노벨 화학상을 수상하게 한 유기 금속 화학 반응이다.
2. 역사
그리냐르 시약 발견 이전인 1849년 에드워드 프랭클랜드는 디알킬아연을 알킬화제로 사용했다. 하지만 디알킬아연은 공기와 접촉하면 쉽게 발화하고, 제조 가능한 알킬기가 제한적이며, 반응성이 높지 않다는 문제점이 있었다.
필립 바르비에는 카르보닐 화합물과 할로겐화알킬의 혼합물에 마그네슘을 작용시키면 할로겐화알킬의 알킬기가 카르보닐 화합물에 부가된 알코올이 생성되는 것을 발견했다. 하지만 반응의 재현성이 좋지 않아 그의 제자인 빅토르 그리냐르에게 더 자세히 연구하도록 권했다.
프랭클랜드는 디알킬아연을 에테르 중에서 제조하는 방법을 시도했었다. 하지만 이 방법으로는 디알킬아연에 에테르가 배위된 화합물이 침전되어 사용하기 어려웠다. 1900년 그리냐르는 이 방법을 마그네슘에 적용하여, 아연과는 달리 균일한 유기금속 화합물 용액을 얻었고, 이 유기금속 화합물이 많은 카르보닐 화합물과 반응한다는 것을 발견했다.[28]
이 유기금속 화합물은 R−MgX 조성을 가지는 것으로 생각되었고, 그리냐르 시약이라 불리게 되었다. 그리냐르는 이 업적으로 1912년 노벨 화학상을 수상했다.
2. 1. 발견
그리냐르 시약 발견 이전에는 1849년 에드워드 프랭클랜드에 의해 디알킬아연이 알킬화제로 사용되었다. 하지만 디알킬아연은 공기와 접촉하면 쉽게 발화하고, 제조할 수 있는 알킬기가 제한적이며, 반응성이 높지 않다는 문제점이 있었다.필립 바르비에는 카르보닐 화합물과 할로겐화알킬의 혼합물에 마그네슘을 작용시키면 할로겐화알킬의 알킬기가 카르보닐 화합물에 부가된 알코올이 생성되는 것을 발견했다. 하지만 반응의 재현성이 좋지 않아 그의 제자인 빅토르 그리냐르에게 더 자세히 연구하도록 권했다.
프랭클랜드는 디알킬아연을 에테르 중에서 제조하는 방법을 시도했었다. 하지만 이 방법으로는 디알킬아연에 에테르가 배위된 화합물이 침전되어 사용하기 어려웠다. 1900년 그리냐르는 이 방법을 마그네슘에 적용하여, 아연의 경우와는 달리 균일한 유기금속 화합물의 용액이 얻어진다는 것과 이 유기금속 화합물이 많은 카르보닐 화합물과 반응한다는 것을 발견했다.[28]
이 유기금속 화합물은 R−MgX의 조성을 가지는 것으로 생각되었고, 이 화합물은 그리냐르 시약이라 불리게 되었다. 1912년 그리냐르는 이 업적으로 노벨 화학상을 수상했다.
2. 2. 발전
그리냐르 시약 발견 이전에는 1849년 에드워드 프랭클랜드가 발견한 디알킬아연이 알킬화제로 사용되었다. 하지만 디알킬아연은 공기와 접촉하면 쉽게 발화하고, 제조할 수 있는 알킬기가 제한적이며, 반응성이 높지 않다는 문제점이 있었다.빅토르 그리냐르의 스승인 필립 바르비에는 카르보닐 화합물과 할로겐화알킬의 혼합물에 마그네슘을 작용시키면 할로겐화알킬의 알킬기가 카르보닐 화합물에 부가된 알코올이 생성되는 것을 발견했다. 하지만 반응의 재현성이 좋지 않아 그리냐르에게 더 자세히 연구하도록 권했다.
프랭클랜드는 디알킬아연을 에테르 중에서 제조하는 방법을 시도했었다. 하지만 이 방법으로는 디알킬아연에 에테르가 배위된 화합물이 침전되어 사용하기 어려웠다. 1900년 그리냐르는 이 방법을 마그네슘에 적용하여, 아연의 경우와는 달리 균일한 유기금속 화합물의 용액이 얻어진다는 것과 이 유기금속 화합물이 많은 카르보닐 화합물과 반응한다는 것을 발견했다.[28]
이 유기금속 화합물은 R−MgX의 조성을 가지는 것으로 생각되었고, 이 화합물은 그리냐르 시약이라 불리게 되었다. 1912년 그리냐르는 이 업적으로 노벨 화학상을 수상했다.
3. 제조
그리냐르 시약(R-MgX)은 유기 할로겐화물(R-X)과 마그네슘 금속(Mg)을 에테르 용매 하에서 반응시켜 제조한다. 이 반응에는 에테르 용매가 필수적인데, 이는 유기마그네슘 화합물을 안정화시키기 때문이다. 물과 공기는 시약을 파괴하므로 반응 조건에서 제외되어야 한다.[1]
일반적으로 다음과 같은 순서로 반응이 진행된다.
할로겐 원소별 반응성은 요오드화 알킬 > 브롬화 알킬 > 염화 알킬 순이며, 불소 화합물은 일반적으로 반응하지 않는다.[3] 같은 할로겐 원소에서는 1차 할로겐화물 > 2차 할로겐화물 > 3차 할로겐화물 순으로 반응성이 크다.
마그네슘 표면은 산화마그네슘(MgO) 막으로 덮여 있어 반응을 방해하므로, 활성화 과정이 필요하다.[4] 활성화 방법은 다음과 같다.
- 기계적 방법: 마그네슘 조각을 분쇄하거나, 빠르게 교반하거나, 초음파 처리한다.[4]
- 화학적 방법: 요오드, 1,2-디브로모에탄, 염화제이수은을 첨가한다.[4] 1,2-디브로모에탄을 사용하면 에틸렌 기포가 발생하는 것을 관찰하여 반응을 확인할 수 있고, 부산물이 무해하다는 장점이 있다. 소량의 염화제이수은은 금속 표면을 아말감화하여 반응성을 높인다.[4]
미리 생성된 그리냐르 시약을 첨가하기도 한다.[4] 리케 마그네슘과 같이 특수하게 활성화된 마그네슘을 사용하면 반응성을 높일 수 있다.[5] 초음파를 사용하거나, 교반 막대로 산화막을 긁어내거나,[6] 요오드 또는 1,2-디요오드에탄을 소량 첨가하여 산화물 층을 파괴할 수도 있다.[7]
그리냐르 시약 제조에는 디에틸 에테르나 THF와 같은 에테르계 용매가 필수적이다. 이는 마그네슘에 배위하여 그리냐르 시약을 안정화시키고 반응성을 높이기 때문이다.[1] 디옥산은 마그네슘 할라이드와 불용성 착물을 형성하여 슐렌크 평형에 의해 그리냐르 시약을 비활성화시키므로 사용하지 않는다.[29] 톨루엔과 같은 방향족 용매도 사용 가능하지만, 그리냐르 시약 생성이 느려 에테르 용매에서 생성 후 용매 치환하는 것이 일반적이다. 트리에틸아민과 같은 3급 아민에서도 그리냐르 시약 제조는 가능하지만, 생성된 그리냐르 시약의 반응성이 낮아 거의 사용되지 않는다.
일반적으로 그리냐르 시약의 농도는 1 mol/L 정도가 되도록 용매를 사용한다. 농도가 너무 진하면 그리냐르 시약이 침전될 수 있고, 역가법이 불가능해질 수 있다. 우르츠 커플링이 일어나기 쉬운 반응성이 높은 할라이드를 사용할 때는 더 묽은 농도로 제조한다.
기타 제조 방법으로는 다음과 같은 방법들이 있다.
- 금속-할로겐 교환 반응: 다른 그리냐르 시약(R'MgX)과 유기 할로겐화물(R-X)을 반응시켜 새로운 그리냐르 시약(RMgX)을 생성한다. 이소프로필마그네슘 클로라이드와 아릴 브로마이드 또는 아이오다이드를 반응시키는 것이 그 예이다.[12]
- 트랜스메탈화 반응: 다른 유기 금속 화합물(R-M)과 할로겐화 마그네슘(MgX2)을 반응시킨다. 이 방법은 실온에서 그리냐르 시약과 반응해 버리는 에스터나 니트릴 등의 작용기를 가진 방향족 화합물의 그리냐르 시약을 제조하는 데 사용된다.[32]
3. 1. 일반적인 방법
가장 일반적인 그리냐르 시약의 제조 방법은 유기 할로겐화물(R-X)과 마그네슘 금속(Mg)을 에테르 용매 하에서 반응시키는 것이다. 이 반응은 유기마그네슘 화합물을 안정화시키기 위해 에테르 용매가 필요하며, 물과 공기는 시약을 파괴하므로 제외된다.[1]반응은 일반적으로 다음과 같은 순서로 진행된다.
1. 잘 건조하고 불활성 기체(질소, 아르곤)로 치환한 반응 용기에 마그네슘을 넣고 교반하여 약간 분쇄한다.[29]
2. 마그네슘이 잠길 정도의 에테르계 용매(디에틸 에테르 또는 테트라히드로푸란)를 넣는다.
3. 요오드나 1,2-디브로모에탄과 같은 활성화제를 소량 첨가하여 가열하고 교반한다.
4. 소량의 할로겐화알킬의 에테르 용액을 첨가하고 교반한다. 반응 용액은 탁해진 후, 그리냐르 시약 생성에 따른 급격한 온도 상승과 함께 검은색에서 갈색의 투명한 용액이 된다.
5. 남은 할로겐화알킬의 에테르 용액을 적절한 반응 온도를 유지하는 속도로 적하한다.
할로겐 원소별 반응성은 요오드화 알킬 > 브롬화 알킬 > 염화 알킬 순이며, 불소 화합물은 일반적으로 반응하지 않는다.[3] 같은 할로겐 원소에서는 1차 할로겐화물 > 2차 할로겐화물 > 3차 할로겐화물 순으로 반응성이 크다.
3. 2. 마그네슘 활성화
마그네슘 표면은 산화마그네슘(MgO) 막으로 덮여 있어 반응을 방해하므로, 활성화 과정이 필요하다.[4] 활성화 방법은 다음과 같다.- 기계적 방법: 마그네슘 조각을 분쇄하거나, 빠르게 교반하거나, 초음파 처리한다.[4]
- 화학적 방법: 요오드, 1,2-디브로모에탄, 염화제이수은을 첨가한다.[4] 1,2-디브로모에탄을 사용하면 에틸렌 기포가 발생하는 것을 관찰하여 반응을 확인할 수 있고, 부산물이 무해하다는 장점이 있다. 소량의 염화제이수은은 금속 표면을 아말감화하여 반응성을 높인다.[4]
미리 생성된 그리냐르 시약을 첨가하기도 한다.[4] 리케 마그네슘과 같이 특수하게 활성화된 마그네슘을 사용하면 반응성을 높일 수 있다.[5] 초음파를 사용하거나, 교반 막대로 산화막을 긁어내거나,[6] 요오드 또는 1,2-디요오드에탄을 소량 첨가하여 산화물 층을 파괴할 수도 있다.[7]
3. 3. 용매 선택
그리냐르 시약 제조에는 에테르계 용매가 필수적이다. 디에틸 에테르나 THF과 같은 에테르계 용매는 마그네슘에 배위하여 그리냐르 시약을 안정화시키고 반응성을 높인다.[1] 마그네슘에 대한 배위력이 높은 용매일수록 그리냐르 시약 생성 반응성이 높아지므로, 디에틸 에테르보다 THF나 1,2-디메톡시에탄이 더 높은 반응성을 보인다. 반응성이 낮은 할라이드인 알케닐 할라이드나 아릴 할라이드로 그리냐르 시약을 제조할 때는 보통 THF를 사용한다. 그러나 THF는 우르츠 커플링을 촉진하므로, 반응성이 높은 요오드화 알킬, 할로겐화 알릴, 할로겐화 벤질로부터 그리냐르 시약을 제조하는 경우에는 수율이 낮아질 수 있다. 이럴 때는 디에틸 에테르에서 그리냐르 시약을 제조한 후 용매를 치환하는 것이 좋다.디옥산은 마그네슘 할라이드와 불용성 착물을 형성하여 슐렌크 평형에 의해 그리냐르 시약을 비활성화시키므로 사용하지 않는다.[29]
톨루엔과 같은 방향족 용매도 사용 가능하지만, 그리냐르 시약 생성이 느려 에테르 용매에서 생성 후 용매 치환하는 것이 일반적이다.
트리에틸아민과 같은 3급 아민에서도 그리냐르 시약 제조는 가능하지만, 생성된 그리냐르 시약의 반응성이 낮아 거의 사용되지 않는다.
일반적으로 그리냐르 시약의 농도는 1 mol/L 정도가 되도록 용매를 사용한다. 농도가 너무 진하면 그리냐르 시약이 침전될 수 있고, 역가법이 불가능해질 수 있다. 우르츠 커플링이 일어나기 쉬운 반응성이 높은 할라이드를 사용할 때는 더 묽은 농도로 제조한다.
3. 4. 기타 방법
금속-할로겐 교환 반응: 다른 그리냐르 시약(R'MgX)과 유기 할로겐화물(R-X)을 반응시켜 새로운 그리냐르 시약(RMgX)을 생성한다. 이소프로필마그네슘 클로라이드와 아릴 브로마이드 또는 아이오다이드를 반응시키는 것이 그 예이다.[12]트랜스메탈화 반응: 다른 유기 금속 화합물(R-M)과 할로겐화 마그네슘(MgX2)을 반응시킨다. 이 방법은 실온에서 그리냐르 시약과 반응해 버리는 에스터나 니트릴 등의 작용기를 가진 방향족 화합물의 그리냐르 시약을 제조하는 데 사용된다.[32]
4. 반응 메커니즘
메커니즘 측면에서, 이 반응은 단일 전자 전달을 통해 진행된다.[8][9][10]
할로겐화알킬과 금속 마그네슘은 일전자 이동을 통해 생성되는 라디칼 중간체를 거쳐 반응한다고 여겨진다.[30] 반응 메커니즘은 다음과 같다. 식에서
:
:
:
:
먼저 할로겐화알킬 R−X가 금속 마그네슘으로부터 전자 1개를 얻어 라디칼 음이온 R−X•−이 된다. 생성된 라디칼 R−X•−에서 할로겐 음이온이 탈리되어 알킬 라디칼 R•이 된다. 탈리된 할로겐 음이온과 앞서 생성된 1가의 마그네슘 양이온은 XMg•를 형성하고, 이것과 R•이 결합하여 RMgX가 생성된다. 이상의 반응은 금속 마그네슘의 표면에서 일어난다고 여겨진다.
5. 조성 및 구조
그리냐르 시약은 일반적으로 R−MgX의 형태로 표기되지만, 실제로는 복잡한 조성을 가진다고 여겨진다. 이를 처음으로 지적한 것은 빌헬름 슈렌크이며, 용액 중에서 다이알킬마그네슘과의 평형이 존재한다는 것을 지적했다.[33]
: 2R−MgX ⇄ R2Mg + MgX2
이 평형은 '''슐렌크 평형'''이라고 불린다.
대부분의 그리냐르 반응은 에테르계 용매, 특히 디에틸 에테르와 THF에서 수행된다. 그리냐르 시약은 1,4-디옥산과 반응하여 유기마그네슘 화합물과 불용성 배위 고분자를 생성한다. (R = 유기기, X = 할로젠 원소):
: 2 RMgX + dioxane ⇄ R2Mg + MgX2(dioxane)2
이 반응은 슐렌크 평형을 이용하여 평형을 오른쪽으로 이동시킨다.
마그네슘은 일반적으로 4배위를 취하기 때문에, 그리냐르 시약의 마그네슘에는 용매인 에테르 분자의 산소가 배위하고 있다. 또한, 그리냐르 시약의 농도와 용매의 종류에 따라서는, 용매나 할로젠 원소를 매개로 하여 여러 마그네슘이 가교 결합한 복핵 착체를 형성하고 있다. 배위력이 강한 테트라히드로푸란이나 1,2-디메톡시에탄에서는 단핵 착체이지만, 디에틸 에테르 중에서는 농도가 높은 경우에는 이핵 착체, 농도가 낮은 경우에는 단핵 착체가 된다고 여겨진다.
그리냐르 시약은 유기리튬 화합물과 반응하여 착물을 생성한다(Bu = 뷰틸):[20]
: BuMgBr + 3 BuLi → LiMgBu3 + BuBr
6. 반응
그리냐르 시약은 다양한 화합물과 반응하여 유기 화합물을 합성하는 데 유용하게 사용된다. 강한 친핵체이자 강염기로 작용하여 다양한 반응을 일으킨다.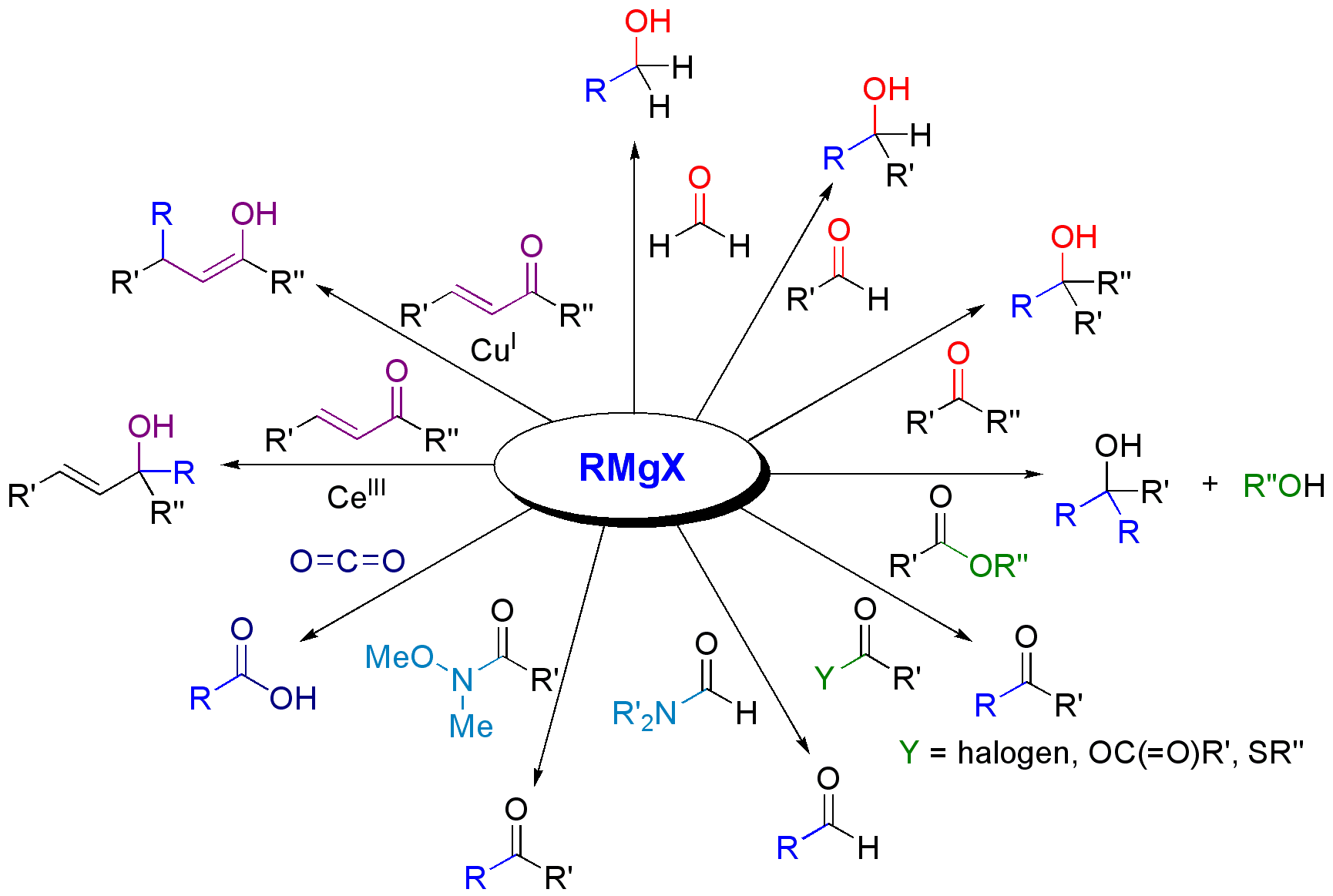
- 친핵성 첨가 반응: 카르보닐 화합물 (알데하이드, 케톤, 에스터 등)과 반응하여 알코올을 생성한다.[15] 이산화탄소와 반응하면 카르복실산이 생성된다.[40][41][42]
- 친핵성 치환 반응: 알릴 할라이드나 벤질 할라이드와 SN2 반응을 통해 탄소-탄소 결합을 형성한다.[44] 에폭사이드와 반응하여 알코올을 생성하며, 이때 그리냐르 시약은 입체적으로 덜 혼잡한 쪽 탄소를 공격한다.[45]
- 염기로서의 반응: 물, 알코올, 아민과 같은 브뢴스테드 산에서 양성자(프로톤)를 떼어내 알케인, 알콕사이드, 아미드를 생성한다. 말단 알킨과 반응하여 알키닐 그리냐르 시약을 만든다.[31][49]
- 기타 반응: 산소와 반응하여 하이드로퍼옥사이드나 알코올을 생성할 수 있다.[22] 전이 금속 화합물과 반응하여 유기 금속 화합물을 생성한다. 쿠마다-타마오 반응과 같은 크로스 커플링 반응에도 사용된다.
그리냐르 반응은 일반적으로 다음 세 가지 방법으로 수행된다.
- 그리냐르 시약 용액에 반응물을 천천히 첨가
- 그리냐르 시약 제조 시 할로젠화 알킬과 함께 반응물을 첨가 (바르비에르법)
- 그리냐르 시약 용액을 반응물 용액에 천천히 첨가 (역적가법)
바르비에르법은 알릴 또는 벤질 그리냐르 시약 반응에 유용하며, 역적가법은 그리냐르 시약의 당량 조절이 필요한 경우에 사용된다.
6. 1. 친핵성 첨가 반응
그리냐르 시약은 다양한 카르보닐 유도체와 반응한다.[15]그리냐르 시약의 가장 일반적인 용도는 알데하이드와 케톤의 알킬화, 즉 ''그리냐르 반응''이다.[16]
보호된 카르보닐인 아세탈 작용기는 반응하지 않는다.
이러한 반응은 일반적으로 수성 산성 후처리가 포함되지만, 반응식에는 거의 표시되지 않는다. 그리냐르 시약이 알데하이드 또는 프로카이랄 케톤에 첨가되는 경우, 펠킨-안 모델 또는 크램 규칙을 사용하여 어떤 스테레오이성질체가 생성될지 예측할 수 있다.
그리냐르 시약은 "카르보닐 유사" 화합물 및 기타 친전자체와도 반응한다.
강한 친핵성과 강염기성으로 인해 반응성이 풍부하여 다양한 화합물을 합성하는 데 유용하다.
반응을 수행하는 방법에는 주로 세 가지 방식이 있으며, 이들을 총칭하여 '''그리냐르 반응'''이라고 한다.
- 그리냐르 시약 용액에 반응시킬 기질을 적가한다.
- 그리냐르 시약을 제조할 때 할로겐화알킬과 함께 기질을 적가한다(바르비에르법).
- 그리냐르 시약 용액을 반응시킬 기질 용액에 적가한다(역적가법).
바르비에르법은 우르츠 커플링을 일으키기 쉬운 알릴이나 벤질의 그리냐르 시약을 반응시키는 경우에 사용된다. 역적가법은 2당량 이상의 그리냐르 시약의 반응이 가능한 기질에 대해 1당량만 그리냐르 시약을 작용시키고 싶은 경우 등에 사용된다. 예를 들어 카르복실산 클로라이드로부터 케톤을 합성하고 싶은 경우 등이다.
다음은 반응의 예시이다.
- 포름알데히드(HCHO)와 반응시켜 산으로 처리하면 1차 알코올(R−CH2OH)이 생성된다.
- 알데히드(R'−CHO)와 반응시켜 산으로 처리하면 2차 알코올(R−CR'(OH)H)이 생성된다.[34][35]
- 케톤(R'−C(=O)−R'')과 반응시켜 산으로 처리하면 3차 알코올(R−CR'(R'')OH)이 생성된다.[36]
- 에스터(R'−C(=O)O−R'')와 그리냐르 시약 2당량을 반응시켜 산으로 처리하면 3차 알코올(R'−CR2OH)이 생성된다. 이때 알코올(R''−OH)도 얻어진다.[37][38]
- 아실 할라이드(R'−C(=O)−X), 산 무수물, 티오에스터와 −78 ℃에서 그리냐르 시약을 반응시키면 케톤(R−C(=O)−R')이 생성된다. 온도가 높으면 생성된 케톤에 대한 추가적인 부가 반응이 진행된다.[39]
- 일반적인 3차 카르복스아미드와의 반응은 반응성이 낮기 때문에 거의 사용되지 않지만, 포름아미드와의 반응은 알데히드 합성법으로 알려져 있다. 또한, 와인레브 아미드와의 반응은 케톤을 합성하는 좋은 방법으로 알려져 있다.
- 이산화탄소와 반응시켜 산으로 처리하면 카르복실산(R−C(=O)OH)을 생성한다.[40][41][42]
- α,β-불포화 카르보닐 화합물과의 반응에서는 일반적으로 1,2-첨가가 우선하지만, 카르보닐기가 입체적으로 방해를 받는 경우에는 1,4-첨가도 일어난다. 1,2-첨가를 선택적으로 수행하려면 세륨염을 첨가하고, 1,4-첨가를 선택적으로 수행하려면 구리염을 첨가하는 것이 효과적이다.
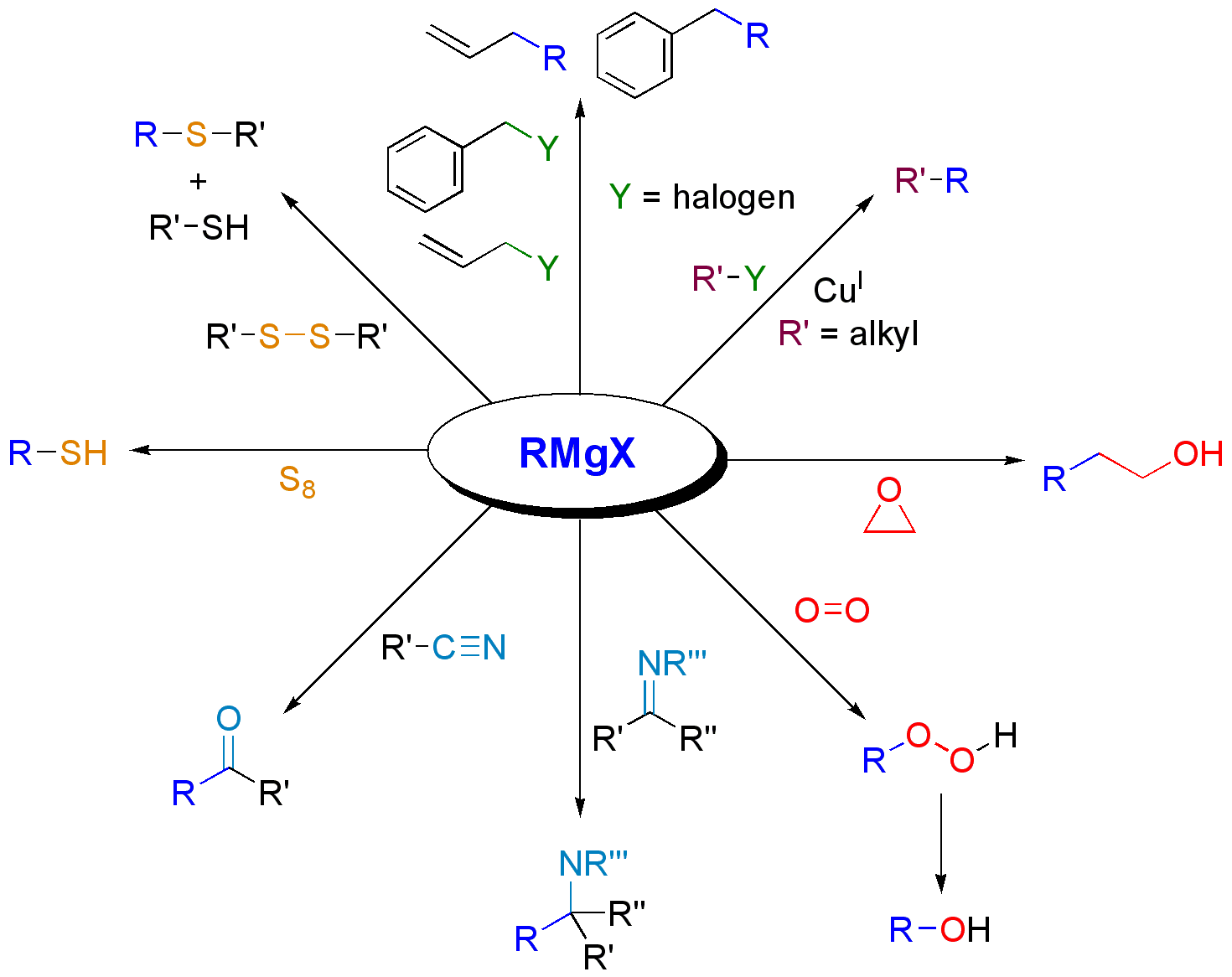
6. 2. 친핵성 치환 반응
그리냐르 시약은 알릴 할라이드나 벤질 할라이드와 SN2 반응을 통해 짝지음 반응을 일으킨다.[44] 다른 할로겐화 알킬은 그대로는 반응하기 어렵지만, 구리 염을 첨가하면 반응이 진행된다.에폭사이드와는 SN2 반응으로 알코올을 생성한다. 이때 그리냐르 시약의 첨가는 입체적으로 비어 있는 쪽의 탄소에서 진행된다.[45]
니트릴(R'−CN)과 그리냐르 시약(RMgX)을 반응시킨 후 산으로 처리하면 케톤(R−C(=O)−R')이 생성된다. 니트릴의 경우 첨가 반응으로 생성되는 이미데이트(R−C(=NMgX)−R')로의 두 번째 첨가가 매우 느리기 때문에, 그대로 산 가수분해하여 케톤이 생성된다.[47]
6. 3. 염기로서의 반응
그리냐르 시약은 강한 염기이므로, 물, 알코올, 아민과 같은 브뢴스테드 산으로부터 양성자(프로톤)를 떼어내어 알콕사이드나 아미드를 생성한다. 말단 알킨에 알킬그리냐르 시약을 작용시키면, 염기로 작용하여 알키닐그리냐르 시약이 생성된다.[49]예를 들어, 그리냐르 시약이 물과 반응하면 알케인이 생성된다.
```
R-MgX + H₂O → R-H + Mg(OH)X
```
말단 알킨과 반응하면 알키닐 그리냐르 시약이 생성된다.[31]
```
R-C≡C-H + R'-MgX → R-C≡C-MgX + R'-H
```
입체 장애가 큰 케톤에 이소프로필이나 tert-부틸과 같이 입체 장애가 큰 그리냐르 시약을 작용시키면, 일부가 염기로 작용하여 에놀레이트가 생성된다. 또한 α-수소를 가지는 나이트릴에서도 일부가 같은 방식으로 반응한다. 이렇게 생성된 음이온은 친핵성 첨가 반응을 받지 않고, 반응 종료 시 산에 의한 가수분해로 원료로 되돌아간다.
6. 4. 기타 반응
그리냐르 시약은 산소와 반응하여 마그네슘 유기 과산화물을 생성한다. 이 물질을 가수분해하면 하이드로퍼옥사이드 또는 알코올을 얻을 수 있다. 이러한 반응에는 라디칼 중간체가 관여한다.[22]일반적으로 알코올을 생성하는 그리냐르 시약의 단순 산화는 수율이 낮아 실용적인 중요성이 거의 없다. 하지만, 보란을 거쳐 2단계 반응 후 과산화수소로 알코올을 산화시키는 방법은 합성적으로 유용하다.[22]
알켄 존재 하에 그리냐르 시약을 산소와 반응시켜 에틸렌이 확장된 알코올을 얻는 방법으로 그리냐르 산화의 합성적 유용성을 높일 수 있다. 이 변형에는 아릴 또는 비닐 그리냐르 시약이 필요하다. 그리냐르 시약과 알켄만을 첨가하면 반응이 일어나지 않으므로 산소의 존재가 필수적이다. 유일한 단점은 적어도 두 당량의 그리냐르 시약이 필요하다는 점이지만, n-부틸마그네슘 브로마이드와 같은 저렴한 환원성 그리냐르 시약을 사용하는 이중 그리냐르 시스템을 사용하여 부분적으로 해결할 수 있다.[22]
그리냐르 시약은 많은 금속 기반 친전자체와 반응한다. 예를 들어, 카드뮴 클로라이드(CdCl2)와 전이금속화 반응을 일으켜 디알킬카드뮴을 생성한다.[19]
:
다른 금속 화합물과 전이금속화를 일으키기 때문에, 임의의 알킬금속 착물을 제조하는 원료로서 중요하다.
또한, 니켈(Ni)촉매 존재 하에 알케닐 할라이드나 아릴 할라이드와 크로스 커플링 반응의 하나인 쿠마다-타마오 반응을 일으킨다.
7. 응용
그리냐르 반응의 한 예로 타목시펜의 산업적 생산에서 핵심 단계를 들 수 있다.[23] 타목시펜은 현재 여성의 에스트로겐 수용체 양성 유방암 치료에 사용된다.[24]
참조
[1]
논문
The Oxidation of Grignard Reagents
[2]
논문
Grignard Reactions in "Wet" Ether
[3]
서적
Handbook of Grignard reagents
CRC Press
[4]
논문
Grignard Reactions in "Wet" Ether
[5]
논문
Preparation of Organometallic Compounds from Highly Reactive Metal Powders
[6]
서적
Organic chemistry
https://archive.org/[...]
Oxford Univ. Press
[7]
서적
Organomagnesium Methods in Organic Chemistry
Academic Press
[8]
서적
Grignard Reagents
John Wiley & Sons
[9]
서적
Advanced Organic chemistry Part B: Reactions and Synthesis
[10]
논문
Grignard reagent Formation
[11]
논문
Preparation of t-Butyl-3-Bromo-5-Formylbenzoate Through Selective Metal-Halogen Exchange Reactions
[12]
논문
Highly Functionalized Organomagnesium Reagents Prepared through Halogen–Metal Exchange
[13]
논문
Adamantyl Metal Complexes: New Routes to Adamantyl Anions and New Transmetallations
[14]
논문
Convenient Titration Method for Organometallic Zinc, Harshal ady Magnesium, and Lanthanide Reagents
[15]
간행물
Butyric acid, α-methyl-
[16]
논문
Total Synthesis of C31-Methyl Ketone Apocarotenoids 2: The First Total Synthesis of (3''R'')-Triophaxanthin
http://actachemscand[...]
2009-11-26
[17]
논문
Synthesis of α-Substituted Allylic Amines via a Modified Bruylants Reaction
[18]
논문
A Multistep Synthesis for an Advanced Undergraduate Organic Chemistry Laboratory
[19]
서적
Chemistry Part II Textbook for class XII
National Council of Educational Research and Training
2019-03-09
[20]
논문
Preparation of t-Butyl-3-Bromo-5-Formylbenzoate Through Selective Metal-Halogen Exchange Reactions
[21]
간행물
4-Nonylbenzoic Acid
[22]
논문
Air-Assisted Addition of Grignard Reagents to Olefins. A Simple Protocol for a Three-Component Coupling Process Yielding Alcohols
[23]
서적
Grignard Reagents: New Developments
Wiley
[24]
논문
Fourteenth Gaddum Memorial Lecture. A current view of tamoxifen for the treatment and prevention of breast cancer
[25]
서적
Advanced Organic Chemistry
John-Wiley & Sons
[26]
서적
Storategic Applications of Named Reactions in Organic Chemistry
Elsevier
[27]
논문
グリニャール試薬,ターボ·グリニャール試薬
https://doi.org/10.5[...]
[28]
논문
Some new organometaric combinations of magnesium and their application to the synthesis of alcohols and hydrocarbons
[29]
논문
Mechanical activation of magnesium turnings for the preparation of reactive Grignard reagents
https://doi.org/10.1[...]
ACS Publications
[30]
서적
Grignard Reagents
John Wiley & Sons
[31]
간행물
2-Alkenyl carbinols from 2-halo ketones: 2-''E''-propenylcyclohexanol
http://www.orgsyn.or[...]
[32]
논문
Preparation and reactions of functionalized arylmagnesium reagents
https://doi.org/10.1[...]
Georg Thieme Verlag Stuttgart New York
[33]
논문
[34]
간행물
''m''-Chlorophenylmethylcarbinol
http://www.orgsyn.or[...]
[35]
간행물
Methyl isopropyl carbinol
http://www.orgsyn.or[...]
[36]
논문
Triphenylethylene
http://www.orgsyn.or[...]
[37]
논문
1,1-Diphenylethylene
http://www.orgsyn.or[...]
[38]
논문
3,12-Diacetoxy-bisnor-cholanyldiphenylethylene
http://www.orgsyn.or[...]
[39]
논문
Tri-tert-butylcyclopropenyl tetrafluoroborate
http://www.orgsyn.or[...]
[40]
논문
DL-Methylethylacetic acid
http://www.orgsyn.or[...]
[41]
논문
Trimethylacetic acid
http://www.orgsyn.or[...]
[42]
논문
α-Naphthoic acid
http://www.orgsyn.or[...]
[43]
서적
Mechanistic features of the reaction of organomagnesium compounds
John Wiley & Sons
[44]
논문
3-Cyclohexyl-2-bromopropene
http://www.orgsyn.or[...]
[45]
논문
n-Hexyl alcohol
http://www.orgsyn.or[...]
[46]
논문
Alkylations of aldehydes via reaction of the magnesioenamine salt of an aldehyde: 2,2-dimethyl-3-phenylpropionaldehyde
http://www.orgsyn.or[...]
[47]
논문
9-Acetylphenanthrene
http://www.orgsyn.or[...]
[48]
논문
Methyl 2-thienyl sulfide
http://www.orgsyn.or[...]
[49]
논문
Trimethylsilylacetylene
http://www.orgsyn.or[...]
[50]
논문
Selective Halogen-Magnesium Exchange Reaction via Organomagnesium Ate Complex
https://doi.org/10.1[...]
ACS Publications
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

